(創薬等PF・構造生命科学ニュースウオッチ 20160419)
 論文→Gerolamo Vettoretti et al. “Molecular Dynamics Simulations Reveal the Mechanisms of Allosteric Activation of Hsp90 by Designed Ligands.” Sci. Rep. 2016 Apr 1;6:23830.
論文→Gerolamo Vettoretti et al. “Molecular Dynamics Simulations Reveal the Mechanisms of Allosteric Activation of Hsp90 by Designed Ligands.” Sci. Rep. 2016 Apr 1;6:23830.
- Corresponding author: Giorgio Colombo (Istituto di Chimica del Riconoscimento Molecolare, CNR (ICRM-CNR))
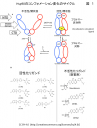
- ATP結合による分子シャベロンHsp90の構造変化と活性化に対するアロステリック部位へのリガンド結合の影響を分子動力学シミュレーションで比較解析:挿入図1の左下に示す活性化リガンド(1, 4, 10, 12, 16, 18)のいずれかを結合した場合と、コントロールとして、アロステリック部位に挿入図1の右下に示す3種類のいずれかの阻害剤を結合させた場合について、シミュレーションを実施。
- Hsp90のATP結合部位であるN末端ドメイン(NTD)の動きに注目し、活性化リガンドと阻害剤の結合が、それぞれ、閉状態と開状態のコンフォメーションを取らせる傾向があることを見出した。また、Hsp90内部構造における柔軟性の分布が、活性化リガンド結合は概ねATP単独結合の場合と同様であったが、阻害剤が結合した場合は全体的に柔軟性が増大していた。
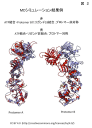
- 活性化リガンド結合の有無によるプロトマーを構成するNTDとMiddle domainの軸の傾きを比較することから、活性化リガンドが結合したプロトマーと活性化リガンド非結合のプロトマーが非対称なコンフォメーションをとることが明らかになった(挿入図1右上の図と挿入図2)。この非対称なコンフォメーションは、ATP加水分解活性化への高エネルギー中間状態に対応する。
- さらに、ATPだけが結合する場合の分子動力学シミュレーションで得られた代表的な10種類のコンフォメーションに対する6種類の活性化リガンドの結合をシミュレーションすることで(Docking over Multiple Receptor Structure)、活性化リガンドによる構造ダイナミクス活性相関解析も行った。
- [情報拠点注] 挿入図は、CC BY 4.0に基づいて原著論文から引用改変。




コメント