(創薬等PF・構造生命科学ニュースウオッチ 2016/09/16)
- [論文] Cas9のアポ構造からdsDNA切断に至るコンフォメーション変化を分子動力学シミュレーションで追跡
- Corresponding author: Giulia Palermo (UCSD)
- Cas9がアポ構造からdsDNA切断に至るまでのPDB登録のCas9アポ構造(4CMQ)、Cas9:sgRNA複合体(4ZT0)、Cas9:sgRNA:DNA複合体(4UN3)、およびdsDNA切断直前のCas9:sgRNA:dsDNA複合体(5F9R)の構造を元に、延べ10μsを超える分子動力学シミュレーションを行った。
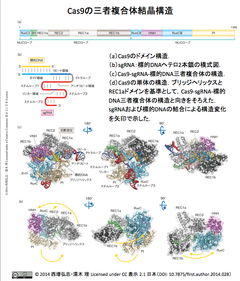
- [注] 参考図は、西増・濡木らによるCas9-sgRNA-標的DNAの三者複合体構造
- Cas9を構成するドメインの協働によってCas9に起こる大規模なコンフォメーション変化と、そのコンフォメーション変化を可能にするそれを可能にする決定的な因子を同定した。
- 標的二本鎖DNAのうちsgRNAに対する非相補DNA鎖がRuvCドメインのグルーブに位置することで局所的コンフォメーションが誘導され、続いて、HNHヌクレアーゼ・ドメインがsgRNA相補的DNA鎖の切断部位へとシフトし、HNHドメインのコンフォメーションの可塑性を介して、HNHのヌクレアーゼ活性が発揮されるに至る。
- 今回明らかになったCas9のコンフォメーション変化とその機構に基づくCRISPR/Cas9システムの改変が可能である。
- [短報] CRISPR/Casシステムは、スペーサー組込みサイトを選ぶことで免疫応答を最適化する
- Corresponding author: Luciano A. Marraffini (The Rockefeller University)
- CRISPR/Casシステムは、侵入DNAの断片(スペーサー)を免疫記憶としてCRISPRアレイに蓄積し原核生物を ウイルスやプラスミドから保護する。新規スペーサーは例外なくCRISPRアレイの5’末端に付加されていくことから、CRISPRアレイの先頭のスペーサーが直近の侵入DNAに対応する。研究チームは今回、リーダー配列に変異を導入すると、新規スペーサーがCRISPRアレイの途中に組込まれ、免疫応答が弱まることを見出した。すなわち、CRISPR/Casシステムは直近の侵入DNAに対して免疫応答を最適化している。
- [論文] CRISPR/Cas9とssDNAオリゴヌクレオチドに拠る点変異の修復を探る
- Corresponding author: Eric B. Kmiec (Helen F. Graham Cancer Center and Research Inst./U. Delaware)
- HCT116-19細胞の、アフィジコリンで細胞周期をS期初期で同期後にリリースした集団と非同期の集団を対象として、CRISPR/Cas9発現ベクター(px330)単独あるいはssODNとともにとエレクトロポレーションし、48時間後に、ゲノム編集の効率の判定とSurveyorアッセイを行った。
- CRISPR/Cas9とssODNによって、点変異修復されたアレルと、標的サイトまたはその周辺の配列が改変された細胞が生成された。
- 解析した26クローンのうち1クローンは、外来のドナーDNA(今回はssODN)とは独立に、遺伝子ファミリー間(ヘモグロビンβ遺伝子とヘモグロビンδ遺伝子の間)で点変異修復が起こることを示唆した。
- [概説] オフターゲット検出法
- Corresponding authors: Francisco Martin; Karim Benabdellah (GENYO-Centre for Genomics and Oncological Research Pfizer-Universidad de Granada-Junta de Andalucía/LentiStem Biotech)
- オフターゲット検出法をガイドRNAが結合する可能性のあるサイトのin silico 予測から始まり、PCRとT7E1アッセイで評価する“biased ditection”と、意図しない切断サイトを何らの条件も付さずに検出する “Unbiased off-target”解析を2ページにあたり概観。後者では、ChIP-dCas9、IDLV capture、GUIDE-seq、LAM-HTGTS及びWGSについて解説。
- [論文] より安全なRNAi法の実現:ゲノム編集技術で抗ウイルスRNAiヘアピンを内在するmiRNAを標的遺伝子座へ導入
- Corresponding author: Dirk Grimm (Cluster of Excellence CellNetworks/U. Heidelberg)
- RNA干渉法は、外来RNAiを外shRNAsまたはmiRNAを埋め込んだmiRNA(shmiRNAs)を細胞に送達し、外来プロモーターで発現させることで、遺伝子ノックダウンを実現し、遺伝子アノテーションに貢献してきたが、効率や安全性の問題を内包していた。研究チームは今回、TALENまたはCRISPR/Cas9を利用してshmiRNAsを細胞内miRNA遺伝子座に組込み、内在プロモーターによって毒性を生じないレベルで発現させることで副作用を低減した。
- この新手法によって、肝細胞における肝臓特異的miR-122/hcr 遺伝子座に抗C型肝炎ウイルスshmiRNAを組込み、抗HCV効果が生じることに成功した。
- [論文] 異種移植を目指したGGTA1ノックアウト・ブタの効率的生産
- Corresponding authors: Bjoern Petersen; Heiner Niemann (Inst. Farm Animal Genetics, Friedrich-Loeffler-Institut)
- ブタのGGTA1 遺伝子は、異種移植における主抗原を構成するブタ細胞のGalエピトープを合成するα1,3-ガラクトース転移酵素をコードする。研究チームは今回、GGTA1遺伝子の第8エクソンを標的とするsgRNAとCas9を受精卵の細胞質へマイクロインジェクションすることで、GGTA1 ノックアウト・ブタの作出に成功した。
コメント