[出典] Simple and large-scale chromosomal engineering of mouse zygotes via in vitro and in vivo electroporation. Iwata S, Nakadai H, Fukushi D, Jose M, Nagahara M, Iwamoto T. Sci Rep. 2019-10-11.
- 中部大学の岩田悟、仲臺 瞳、上瀬茉美、長原美樹ならびに岩本隆司と愛知県医療療育総合センターの福士大輔は、ZFN, TALENあるいはCRISPR-CasのmRNAをマウス受精卵に簡便に導入することを可能とした三段階のエレクトロポレーション法TAKE (Technique for Animal Knockout system by Electroporation)[1]を利用して、CRISPR/Cas9 RNPとssODNを体外受精由来のマウス受精卵に導入し、2細胞期まで成熟後に偽妊娠Slc:ICRマウスへ移植することで、7.67 Mbの規模の標的染色体逆位を帯びた胎仔を得た。
- 2細胞期での生存率が37,4 % (89/238)と低かったが、12匹のSlc:ICRマウスのうち6匹から得た仔の10匹のうち1匹が狙った染色体逆位を帯びていた (Figure 1引用下図参照)。
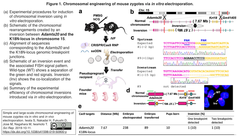
- こうして、これまでCRISPR/Cas9システムをマウス受精卵にマイクロインジェクションすることで得られたマウス染色体逆位の規模は5 Mbに止まっていた (Sci Rep 2017)が、マイクロインジェクションよりも簡便なエレクトロポレーションにより、より大規模な染色体逆位を実現した。
- 研究グループは、エレクトロポレーション法の一種でもあるi-GONAD法 [2]により、前述と対象部位は異なるが、Cas9 RNPとssODNのin vivoエレクトロポレーションを介して、4.54 Mbの規模の染色体逆位を実現した (Figure 2引用下図参照)。

- さらに、F1ハイブリッドマウス (B6C3F1)において、雄と雌のゲノムに特有なSNPを手がかりとして、in vivoエレクトロポレーションでのアレル特異的な逆位または劣性致死に至るアレル特異的大規模欠失を実現した。
[参考論文とcrisp_bio記事]
- Simple knockout by electroporation of engineered endonucleases into intact rat embryos. Kaneko T, Sakuma T, Yamamoto T, Mashimo T. Sci Rep. 2014-10-1. (下図はFigure1を引用)

- CRISPRメモ_2019/07/25 [第1項] [プロトコル] i-GONAD
コメント