2021-02-28 The CRISPR Journal誌からの刊行論文の書誌情報とリンクを追加 (挿入図はbioRxiv版から引用)
2020-09-08 初稿
-----------------------
[出典] Self-cutting and integrating CRISPR plasmids (SCIPs) enable targeted genomic integration of genetic payloads for rapid cell engineering. Bloemberg D [..] McComb S. bioRxiv 2020-09-01; CRISPR J. 2021-02-19. https://doi.org/10.1089/crispr.2020.0090
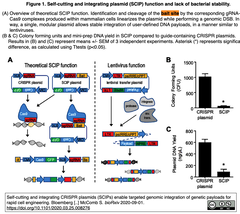 Human Health Therapeutics Research Center (Ottawa)の研究グループは、Cas9-sgRNAとノックイン用ドナー配列に加えてsgRNAの標的となる配列 (bait)を埋め込んだ環状のプラスミドを設計し、Cas9-sgRNAがDNAを標的部位で切断し、同時に環状プラスミドをbaitで切断して直鎖状のプラスミドを生成することで、効率のよい遺伝子ターゲッティングが可能になるという仮説をたてて、実験を開始した [Fig. 1引用右図のA左側を参照]。
Human Health Therapeutics Research Center (Ottawa)の研究グループは、Cas9-sgRNAとノックイン用ドナー配列に加えてsgRNAの標的となる配列 (bait)を埋め込んだ環状のプラスミドを設計し、Cas9-sgRNAがDNAを標的部位で切断し、同時に環状プラスミドをbaitで切断して直鎖状のプラスミドを生成することで、効率のよい遺伝子ターゲッティングが可能になるという仮説をたてて、実験を開始した [Fig. 1引用右図のA左側を参照]。しかし、右図B-Cにあるようにノックイン効率が極めて低かったことから、リーキーなCas9とgRNAの発現によってプラスミドが分解されると考え、cas9配列にマウス由来のイントロンを挿入したところ、プラスミドの安定化と生産性を高めることに成功した。
SCIPの性能をGFP/EGFPのノックインで検証した上で、GFP/EGFPに加えて任意のDNA配列 (DNA payload) のノックインを可能とするSCIPpayを設計し、BFPの発現で検証した後 [Figure 6 引用左下図参照]、Jurkat細胞のCD69遺伝子座へのtdTomatoノックインを介したT細胞活性レポータ、TRAC遺伝子座へのCAR遺伝子ノックイン *[Figure 8 引用右上図参照]を実現した。なお、遺伝子ノックアウトは、SCIPpayでDNA payloadを組み込まない構成のプラスミドによって実現した。
[*] CRISPR技術によるCAR-T細胞作出に関するレビューと論文
(注) 論文はデリバリーにウイルスを使用しない、または、非ウイルスとウイルスを併用した例
(注) 論文はデリバリーにウイルスを使用しない、または、非ウイルスとウイルスを併用した例
- [レビュー] CRISPR-Cas9により内在TCRを望ましいTCRに置換する技術の現状と展望
- RNPをエレクトロポレーション + ドナー遺伝子をrAAV6にて: Targeting a CAR to the TRAC locus with CRISPR/Cas9 enhances tumour rejection. Eyquem J, Mansilla-Soto J [..] Sadelain M. Nature 2017-05-02.
- Cpf1 mRNAをエレクトロポレーション + gRNAとドナーDNAをAAV6にて: One-step generation of modular CART with AAV-Cpf1. Dai X, Park JJ [..] Chen S. Nat Methods 2019-02-25.
- RNPとドナー遺伝子いずれもエレクトロポレーション: Reprogramming human T cell function and specificity with non-viral genome targeting. Roth TL, Puig-Saus C [..] Marson A. Nature 2018-07-11.


コメント