1.超好熱性アーケアPyrococcus furiosus CRISPR-Casシステムにおけるスペーサー獲得は、DNA自由末端とPAMに依存する
- 【出典】“Role of free DNA ends and protospacer adjacent motifs for CRISPR DNA uptake in Pyrococcus furiosus” Shiimori M 〜 Graveley BR, Terns MP. Nucleic Acids Res 25 September 2017.
- 超好熱性アーケアのPyrococcus furiosusは、プラスミド(外来DNA)とホストゲノム(自身のDNA)の双方の断片をスペーサーとしてCRISPRアレイに取込む(挿入図は提案モデル)。

- 新たに取込むスペーサーの大多数はPAM配列(5’-CCN-3’)の直下のDNAに由来した。
- 興味深いことに、スペーサーとして取り込まれる対象領域が、活性トランスポゾン、CRISPR遺伝子座、rRNA遺伝子、ローリングサークル型複製開始点、および、プラスミドが宿主染色体と組換えを起こす領域に、偏っていた。これら領域にはDNAのニッキングやDSBの可能性が存在することが共通している。
- 以上から、バクテリアに関する先行研究の報告と合わせて、DNAのフリーな一本鎖とPAMが原核生物におけるスペーサー獲得に共通な特徴であることが示唆された。
- P. furiosuの致死的自己標的は、外来可動性遺伝子要素(MGE)を排除する機能を担っていることも示唆された。
2.CRISPR/Cas9によるDSBのNHEJ修復過程を、出芽酵母で詳細に解析
- 【出典】“CRISPR/Cas9 cleavages in budding yeast reveal templated insertions and strand-specific insertion/deletion profiles” Lemos BR 〜 Haber JE. bioRxiv. Posted September 25, 2017. (CC-BY-NC-ND 4.0)
- Cas9とgRNAの標的DNAへの結合の向きが、切断サイトに発生するindelsのパターンに大きく影響する;Cas9編集により1-bp挿入が発生、これはDSB部位に発生する1-bp 5’オーバーハングをテンプレートとするPol4依存修復の結果; Cas9によるDSBのNHEJ修復はMre11-Rad50-Xrs2複合体に依存する。
3.Anti-CRISPRタンパク質データベースの構築・公開
- 【出典】“Anti-CRISPRdb: a comprehensive online resource for anti-CRISPR proteins” Dong C 〜 Guo FB. Nucleic Acids Res 25 September 2017.
- CRISPR/Casの活性調節を介してオフターゲット作用を抑制することで、CRISPR/Casよる遺伝子編集、特に、遺伝子治療、への実用化に貢献することが期待されるanti-CRISPRタンパク質のデータベース(挿入図はDB構築フローチャート)。
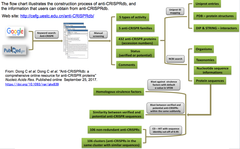
- データコンテンツは、タンパク質配列、DNA配列、コーディング領域、由来生物種、分類体系、毒性、タンパク質間相互作用及び3次元構造;CD-HITにより106クラスターに分類
- これまでに、anti-I-F, anti-I-E, anti-II-A, anti-II-C and anti-VI-Bが同定されてきたが、他のサブタイプにもanti-Casが存在すると思われる。
論文に掲載されているWebサイトURL(http://cefg.uestc.edu.cn/anti-CRISPRdb/)は日本時間9月25〜6日の時点ではアクセできず。2022-04-03 Anti-CRISPRdb v2.2 [http://guolab.whu.edu.cn/anti-CRISPRdb]がDatabase 誌から2022-03-04に発表された.
4.ヒト初代細胞におけるエンハンサーのコネクトームから疾患関連DNAエレメントの標的遺伝子を同定
- 【出典】“Enhancer connectome in primary human cells identifies target genes of disease-associated DNA elements” Mumbach MR 〜 Greenleaf WJ, Chang HY. Nat Gen. Published online 25 September 2017.;bioRxiv Posted August 26, 2017.
- H3K27ac HiChIPを利用して、ナイーブT細胞、TH17細胞およびTreg細胞における活性なエンハンサーと標的遺伝子の高精度なコンタクト・マップ(コネクトーム)を作成し、T細胞のサブタイプに特異的なエンハンサーとプロモーターの相互作用(特に、DNAアクセシビリティを共有する領域)を同定。GWASから同定されていたノンコーディング領域SNPsとその標的遺伝子の対応関係から自己免疫疾患のリスク変異を推定。HiChIP推定遺伝子を、eQTLとCRISPRi で検証。
- ヒト冠状動脈平滑筋初代細胞についてもアレル特異的HiChIPにより、高精度なエンハンサーとプロモーターマップを作成し、心血管疾患に相関する変異を同定。
- HiChIPで推定した標的遺伝子をCRISPRiとCRISPRaで検証
- 疾患関連エンハンサーの大多数が、ゲノム一次元の上でいくつかのプロモーターを飛ばすことも含めて、直近の遺伝子よりも遠位(すなどの遺伝子にコンタクトし、結果的に、自己免疫疾患と心血管疾患の標的候補遺伝子数が4倍に拡大した。
5.CRISPRによる体細胞ゲノム編集の臨床展開が、臨床医、規制団体及びヒト研究倫理委員会に突きつける課題
- 【出典】“Key challenges in bringing CRISPR-mediated somatic cell therapy into the clinic” Nicol D 〜 McWhirter RE. Genome Med. 25 September 2017.
- 生殖細胞系列ゲノム編集よりも、体細胞ゲノム編集の臨床応用の環境を整えることが、患者により直接的なメリットをもたらし波及効果も大きいという観点から、論点整理。
コメント