1. 腫瘍特異的にCRISPR/Cas9を送達しHIF-1αをノックダウンすることで膵臓癌の増殖と転移を抑制
[出典] "Knockdown of hypoxia-inducible factor-1 alpha by tumor targeted delivery of CRISPR/Cas9 system suppressed the metastasis of pancreatic cancer" Li M [..] He Q. J Control Release 2019-05-14.
- 四川大学華西薬学院と四川大学の研究グループによる腫瘍組織特異的なCRISPR-Cas遺伝子編集:HIF-1αを標的とするsgRNAとCas9のプラスミドおよび抗癌剤パクリタキセル (PTX/タキソール)を内包したカチオン性リポソームを膜透過ペプチドR8-dGRで修飾したR8-dGR-Lip/PTX/pHIF-1αが、ヒト膵臓腺癌細胞BxPC-3を標的とし、細胞膜を透過し細胞内でHIF-1αとその下流のVEGFとMMP-9を下方制御することで転移能を抑制し、同時にHIF-1αの下方制御を介してPTXの抗腫瘍性を亢進することで腫瘍細胞の増殖を抑制した。
- R8-dGR-Lipはペグ化脂質粒子よりも腫瘍組織内に広範囲に到達する一方で、正常な肝細胞におけるHIF-1α発現には影響を及ぼさないことも見出した。
2. 筋ジストロフィーモデルマウス (mdxマウス)において、CRISPRゲノム編集による長期間で安全な心筋症改善を実現
[出典] "Life-long AAV-mediated CRISPR genome editing in dystrophic heart improves cardiomyopathy without causing serious lesions in mdx mice" Xu L, Liu YS, Gao Y, Li H, Han R. Mol Ther 2019-05-14.
- Ohio State University Wexner Medical CenterのR. Hanらは、ジストロフィン遺伝子のイントロン2ヶ所 (20と23)を標的とするSaCas9とgRNAを帯びたAAVrh.74ベクター2種類を3日齢のmdxマウス胎仔に注入し19ヶ月後に評価し、ジストロフィンの発現が回復し心機能が改善されたことを確認した。腫瘍発生を含む副作用は発生せず、SaCas9の切断部位は精密に再連結されていた。
3. CRISPR-Cas9を足場タンパク質のもとに自己組織化するナノシステムを送達し、DNA酵素で活性化
[出典] "DNAzyme activated protein-scaffolded CRISPR–Cas9 nanoassembly for genome editing" Zhu X, Lv MM, Liu JW, Yu RQ, Jiang JH (湖南大学). Chem Commun (Camb). 2019-05-17.
[crisp_bio注] 本投稿は、タイトルと概念図だけに基づいています。
DNA酵素参考記事と論文
- 2017-06-16 DNA酵素(DNAzyme)の構造基盤
- "Metal ion-directed dynamic splicing of DNA through global conformational change by intramolecular complexation" Ihara T et al. Nat Commun 2015-04-07.
4. [ミニレビュー] クロストリジウム属のCRISPRゲノム編集システム
MINIREVIEW "CRISPR genome editing systems in the genus Clostridium: a timely advancement" McAllister KN, Sorg JA. J Bacteriol 2019-05-13
- 野生型Cas9; dCas9/CRISPRi; Cpf1/Cas12a; 内在CRISPRシステム
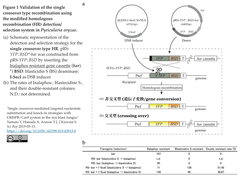
5. イネいもち病菌 (Pyricularia oryzae)をモデルとして糸状菌の高効率なCRIPSR/Cas9遺伝子編集を実現
[出典] "Single crossover-mediated targeted nucleotide substitution and knock-in strategies with CRISPR/Cas9 system in the rice blast fungus" Yamato T, Hanada A, Arazoe T [..] Kuwata S. Sci Rep 2019-05-15.
- 明大、理科大および農工大の研究グループは今回、産業上有用な菌を多種含む一方で、アフラトキシンを含む有害物質を産生するヒト病原菌や植物病原菌も含む糸状菌のグループを対象とする遺伝子工学ツールを開発し、標的遺伝子座における塩基置換、終止コドンを帯びたドナーを介した標的遺伝子破壊、および標的遺伝子のC末端へのGFP遺伝子ノックインを実現した。
- 糸状菌ではこれまで、MMEJを介したノックインを含めて相同組み換え(HR)修復を介した比較的効率的な遺伝子改変が報告されてきた。HR修復過程には非交叉型 (遺伝子変換/gene conversion)と交叉型 (crossingover)の2種類がある。研究グループは始めに、P. oryzaeにおけるHR修復過程における非交叉型と交叉型の発生を、先行研究で開発していたHR検出/選別用レポータに基づいて判定し (原論文 Figure 1引用下図参照)、部位特異的DSBがP. oryzaeに交叉型HRを高い効率で誘導することを同定し、交叉型HRを介してP. oryzaeの前述の遺伝子改変を実現した。
コメント