(創薬等PF・構造生命科学ニュースウオッチ 2016/10/29)
- Corresponding author: Peter M. Glazer (Yale U.)
- 鎌状赤血球症やβ-サラセミアは遺伝子修復の格好の標的とされ、今や生命科学を席巻しているCRISPR/Cas9システムによる修復の試みも相次いでいる[注]。
- 研究チームは今回、ペプチド核酸(peptide nucleic acid, PNA)に基づく新システムによって生体内遺伝子修復を実現した。
- PNA鎖はDNA鎖やRNA鎖と異なり電荷的に中性なペプチド構造を主鎖とすることからDNA鎖とDNA鎖よりも強くDNA鎖に結合する。PNAはゲノムDNAに侵入し、それによって変位したDNA鎖とPNA/DNA/PNAの三重鎖を形成し、この三重鎖が細胞に内在するDNA修復システムをリクルートする。この時、’donor DNAs’が共存していれば、修復のテンプレートとして利用される。
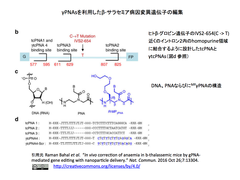
- 研究チームは今回、先行研究の知見を生かして“tail-clamp” PNAs (tcPNAs)のガンマ位をミニ・ポリエチレングリコールで置換した次世代PNAs(MPγPNA:参考図参照)を使用し、さらに、幹細胞因子(SCF)/c-Kitパスウエイを刺激することで、ヒトβ-サラセミアのマウスモデルおいて、効果的に造血幹細胞(HSCs)を遺伝子編集することが可能なことを示した。
- SCFと、γPNAsと’donor DNA’として機能するヘモグロビンサブユニットβ(HBB)をコードするDNAを封入した乳酸・グリコール酸共重合体(Poly Lactic-co-Glycolic Acid, PLGA)製ナノ粒子を、モデルマウスに静脈注射した。
- βーグロビン遺伝子の修正効率は従来の遺伝子治療の効果を大きく超える7%に達し、疾患症状の改善に十分であった。すなわち、静脈注射後140日間にわたって、ヘモグロビンの血中濃度が上昇し、網状赤血球数が減少し、脾臓の腫れが引いた。また、ex vivoでのCD34陽性HSCsの遺伝子編集の効率は5%に達し、オフターゲット作用は極めて小さかった。
- ナノ粒子による送達、Cas9よりはるかに小型でありエンドヌクレアーゼ活性を持たずオフターゲット作用が最小限の次世代γPNAs、そしてSCF処理の組み合わせは、安全かつ静脈注射という簡便な遺伝性血液疾患療法への扉を開いた。また、SCF処理はCRISPR/Casゲノム編集にも有用と考えられる。
- [注] 血液疾患病因変異のCRISPR/Cas9技術による修復に関する創薬等PF・構造生命科学ニュースウオッチ記事
- 2016/10/15 CRISPR関連文献メモ 1.[論文] 鎌状赤血球症の病因変異をCRISPR/Cas9を介した相同組換え修復(HDR)で正常化
- 2016/09/12 CRISPR関連文献メモ 3.[論文] CRISPR/Cas9技術を利用して胎児型ヘモグロビンを誘導することで鎌状赤血球症 (SCD)とβサラセミアを治療する
- 2016/08/19 βヘモグロビン異常症を自然に倣って遺伝子治療する可能性
コメント