[出典] "Computational design of anti-CRISPR proteins with improved inhibition potency and expanded specificity" Mathony J, Harteveld Z, Schmelas C [..] Correia BE, Niopek D. bioRxiv 2019-06-27 > Nat Cell Biol 2020-04-13.
- これまでAcrsは、配列データベースのマイニングまたはファージライブラリからのスクリーニングから得られた天然タンパク質に限られていたが、University of HeidelbergとSwitzerland and Swiss Institute of Bioinformaticsなどドイツ・スイスの研究グループは今回、タイプII-C CRISPRシステムを幅広く阻害するAcrIIC1*のタンパク質工学による高性能化を試みた (* CRISPRメモ_2017/08/27 [第4項] 抗-CRISPRタンパク質 (anti-CRISPR proteins) 群の多彩なCas9阻害機構)
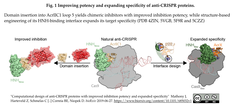
- はじめにAcrIIC1のloop 5にドメイン (LOV2、mCherry)を融合することで Neisseria meningitidisCas9に対する阻害能を高め (原投稿Fig 1引用下図左の左側参照)、次に、AcrIIC1の構造に基づいて、in vivoゲノム編集に広く利用されているStaphylococcus aureusに由来するタイプII-A CRISPR-Cas9を阻害するAcrXを設計・作出した (原投稿Fig.1引用下図左の右側と、FIg. 3引用下図右参照)。

2. 大規模な合成DNAライブラリーを対象とするSaCas9によるDNA切断活性の実験結果から、ミスマッチへ寛容性のgRNA依存性を見出し、そのニューラルネットワーク・モデルを構築
[出典] "Identification of Guide-Intrinsic Determinants of Cas9 Specificity" Huston NC [..] Steinberg BE. CIRSPR J 2019-06-21.
- Editas Medicineの研究チームは今回、10の6乗のメンバからなる DNAバーコード付き合成DNAライブラリ"barcoded library of targets (BLT)"を構築し、SaCas9のメンバに対する結合と切断をアッセイ (原論文FIG. 1引用下図左参照)し、その結果に基づいて、gRNAに依存するミスマッチ寛容度 (A guide-intrinsic mismatch permissiveness: GIMP)を定義・計算し (原論文FIG. 3引用下図右参照)、オフターゲット予測モデルを構築した。また、SaCas9が結合後にDNAを切断する確率Pcutも定義・計算し、PcutもgRNAに依存することを見いだした。BLTからのアプローチは他のCasヌクレアーゼにも展開可能である。


3. 多重gRNAsを利用したCRISPRホーミング遺伝子ドライブをシミュレーションと実験により評価
[出典] "Computational and experimental performance of CRISPR homing gene drive strategies with multiplexed gRNAs" Champer SE [..] Champer J. bioRxiv 2019-06-23.
- 耐性アレルの発生によるCRISPRホーミング遺伝子ドライブ*の阻害をsgRNAsを多重化することで解決できる可能性がある。
- Cornell Universityの研究グループは今回、DNA切断機序に関わるさまざまな要因を取り入れた遺伝子ドライブモデルを開発し、検証実験を経て、sgRNAsの多重化は問題を完全に解決するまでには至らないが、ドライブのタイプそれぞれに、2~8 sgRNAsの範囲で最適な多重化が存在することを同定した。
- (*) 関連crisp_bio記事:2019-05-29 抵抗は無駄だ:ハプロ致死性遺伝子を標的とするCRISPRホーミング遺伝子ドライブ
4. CRISPR-Cas antimicrobials: CRISPR-Cas9を接合伝達することで抗生物質耐性エンテロコッカス属を特異的に殺菌する
[出典] "Conjugative delivery of CRISPR-Cas9 for the selective depletion of antibiotic-resistant enterococci" Rodrigues M [..] Palmer KL, Duerkop BA. bioRxiv 2019-06-21.
- グラム陽性腸球菌の一種であるEnterococcus faecalisの院内感染に対する抗生物質療法は限られており、新たな療法が求められている。先行研究からE. faecalis内在のタイプII CRISPR-Casシステムを利用して薬剤耐性因子を除去する手法を報告していたUniversity of Texas at DallasとUniversity of Colorado School of Medicineの研究グループは今回、E. faecalisに効率的に伝播するフェロモン応答性の接合性プラスミドに薬剤耐性遺伝子を標的とするCRISPR-Cas9システムをコードすることで、E. faecalisの選択的かつ効率的な殺菌を実現し、このプラスミドをCRISPR-Cas antimicrobialsと称した。
- In vitroでの競合実験で性能を実証した後、CRISPR-Cas antimicrobialsがマウス腸内の薬剤耐性E. faecalisの発生を顕著に抑制することを確認し、さらに、CRISPR-Cas antimicrobialsを帯びたE. faecalisが、薬剤耐性遺伝子に対して免疫応答することを確認した。
5. CRISPRシステムを利用したゲノム領域の配列置換を介して、ゲノム編集とエピゲノム編集の同時実行を実現
[出典] "Concurrent Genome and Epigenome Editing by CRISPR-Mediated Sequence Replacement" Alexander J, Findlay GM, Kircher M, Shendure J. bioRixv 2019-06-20.
- CRISPR/Cas9によるDSBからのNHEJまたはHDR過程によりゲノム編集が可能になり、dCas9にDNAメチルトランスフェラーゼを融合することで、CpGアイランドのメチル化をはじめとするエピゲノム編集が可能になった。
- University of Washington, Seattleの研究チームは今回、dCas9へのメチル化酵素融合に換わるより簡便なエピゲノム編集手法を開発した。
- この手法では、in vitroでメチル化したDNA断片の存在下で、標的ゲノム領域の両端の2ヶ所をCRISPR/Cas9で切断することで、標的領域をメチル化DNAに置換する。この手法により、HPRT1遺伝子のプロモータをメチル化によるHPRT1遺伝子のサイレンシング、エピゲノム編集とゲノム編集の同時実行、を実証した。
6. 遺伝子合成が不要で効率的でモジュール型のCRISPRベクターシステムを開発し、モデル植物の一種であるヒメツリガネゴケの多彩なゲノム編集を実現
[出典] "Efficient and Modular CRISPR-Cas9 Vector System for Physcomitrella patens" Mallett DR, Chang M, Cheng X, Bezanilla M. bioRxiv 2019-06-18.
- Dartmouth Collegeの研究チームは今回、ヒカリツメゴケにおいて、12遺伝子座の同時編集、4ヶ所に分散したヌル遺伝子座を帯びた系統樹立、コーディング領域の5'末端と3'末端のタギング、Cas9切断部位近傍でのヌル・アレル生成などを実現した。
7. [投稿] 遺伝する遺伝子編集医療は、医療大麻に倣って、ライセンス制を導入せよ
[出典] CORRESPONDENCE "License heritable gene editing like medical cannabis" Julian H(Bristows LLP). Nature 2019-06-25.
- 著者は「モラトリウムは無秩序で潜在的に有害な医療のブラックマーケットを形成する」とし、公衆衛生の観点から、医療大麻と同様に、一定の標準に基づいてヒト胚ゲノム編集を含む遺伝するゲノム編集医療を管理するライセンス制度を早急に導入すべき、と主張した。
- Hitchcock JulianはNuffield Council on Bioethics’ 2018 report*の著者の一人: (*) CRISPRメモ_2018/07/19 [第7項] ナフィールド生命倫理審議会は、次世代に影響を及ぼすヒト胚、精子または卵子のDNAの編集'heritable genome editing interventions'を許容する、と結論
コメント