[出典] Functional profiling of single CRISPR/Cas9-edited human long-term hematopoietic stem cells. Wagenblast E [..] Dick JE, Lechman ER. Nat Commun. 2019-10-18.
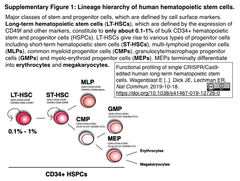
ヒト造血システムにおいて、自己複製能と多分化能を帯びた長期 (Long-Term)造血幹細胞 (LT-HSCs)は 、CD34陽性造血幹細胞・前駆細胞 (HSPCs)集団の0.1-1%に過ぎないが 一生にわたる血液細胞の源であり、それゆえ、遺伝性血液疾患の治療や再生医療の標的とされてきた (ヒト造血幹細胞の分化過程についてSupplementary Figure 1引用下図参照)。
近年、CRISPR/Cas9技術により、NHEJを介したCD34陽性HSPCsの遺伝子ノックアウト効率80-90%、HDRを介したノックイン効率20%およびrAAV9で導入した蛍光レポータとFACSによるCRISPR/Cas9編集細胞のエンリッチメントが実現されてきた。HSPCsのごく一部であるLT-HSCsについても、CRISPR/Cas9で編集したヒトCD34陽性HSPCsを異種移植し16週に至るまで解析した実験から、LT-HSCsの遺伝子編集が可能なことが示唆された。しかしこれは、膨大な数のCD34陽性HSPCsから出発した実験であり、個々のLT-HSCsの分化と増殖を解析するまでの分解能には至らなかった。
Princess Margaret Cancer Centre (トロント)とThe Jackson Laboratoryなどの研究グループは今回、不均一なCD34陽性HSPCs内でのLT-HSCsのCRISPR/Cas9遺伝子編集に替わり、LT-HSCsだけを対象とするCRISPR/Cas9によるNHEJまたはHDRを介した遺伝子編集と、それに続く、in vitroでのシングルセルの分化とマウスへの'near clonal'異種移植の長期間にわたる分析を実現した。
LT-HSCs分化過程でのGATA1アイソフォームの発現をモデルとして実験
- 解析モデルとして、新生児臍帯血由来のLT-HSCs、short-term hematopoietic stem cells (ST-HSCs)ならびに分化したMEPsにおいて、その変異が種々の血液疾患を引き起こす転写因子GATA1のアイソフォームの発現を対象とした。
- GATA1遺伝子からは、選択的スプライシングを経て、全長のGATA1 (GATA1-Long)と短縮型 (GATA1-Short)の2種類のタンパク質アイソフォームが生成される。GATA1のexon 2における変異に因りアイソフォームの中でGATA1-Shortのみが生産されるようになり、ダウン症児童に未成熟な巨核球の異常な増殖を伴う急性巨核芽球性白血病 (AKML)を引き起こすとされている。
- GATA1-Shortが巨核球増殖に及ぼす作用はこれまで、胎児HSPCsで現れ、新生児または成人のHSPCsでは現れないとされてきた。すなわち、発生段階に特異的な作用と想定されてきた。この仮説を検証するために、GATA1アイソフォームの発現の追跡をモデルとして選択した。
実験ワークフローの概要
- フローサイトメトリーを介して、異種移植用のLT-HSCsと、in vitro分化実験様のLT-HSCs、ST-HSCsならびにMEPsを分離し、それぞれ48時間培養後に、IDT社のAlt-R® CRISPR/Cas9 crRNAとtracrRNAに由来するsgRNAとCas9タンパク質からなるRNPをエレクトロポレーションした (Fig.1-a 引用下図参照)。

- GATA1-ShortアイソフォームとGATA1-Longアイソフォームどちらか一方だけの発現をそれぞれ、上図bと上図cにあるように、NEHJを介したエクソン2の欠損と、HDRを介したエクソン3上のATGからCTCへの置換により実現した。なお、GATA1はX連鎖であることから、雄の臍帯血にて実験を進め、コントロール用のsgRNAは嗅覚受容体 OR2W5のエクソン1を標的とした。
GATA1-Shortの作用
- シングルセルのin vitro分化実験においても、異種移植マウスin vivo実験においても、新生児臍帯血由来のLT-HSCsにおいて、内在プロモータによるGATA1アイソフォームのうちGATA1-Short限定の発現が、巨核球への分化を亢進することが示された。
- すなわち、LH-HSCsだけの集団のCRISPR/Cas9遺伝子編集を介して、これまでの臍帯血由来バルクのCD34陽性HSPCsを対象とする遺伝子編集実験では見出されることがなかった現象を見出すに至った。
コメント