[出典] "In vivo CRISPR/Cas9 targeting of fusion oncogenes for selective elimination of cancer cells" Martinez-Lage M, Torres-Ruiz R [..] Rodriguez-Perales S. Nat Commun. 2020-10-08.
融合癌遺伝子 (Fusion oncogenes: FOs)は多くの癌に共通し、腫瘍を形成する強力なドライバーである。FOの発現は癌細胞に特異的で正常細胞には見られないことから、FOsを除去することで、正常細胞を損傷することなく、FOに依存する癌を細胞死へと誘導することを期待できる。FOは魅力的な治療標的である。
融合癌遺伝子を標的とするCRISPR/Cas9療法として、University of Pittsburgh School of Medcineのグループ*が、融合癌遺伝子に自殺遺伝子を挿入する手法を開発したが、編集効率が低いことと、患者固有のブレイクポイントに合わせたsgRNAの設計が必要になることが課題であった。
[* Chen ZH et al. "Targeting genomic rearrangements in tumor cells through Cas9-mediated insertion of a suicide gene" Nat Biotechnol. 2017-05-01.
- この手法は、FOに位置する2ヵ所のイントロン領域をCRISPR/Cas9により切断し、細胞内在のNHEJを介した修復過程を介して、FOが除去される機序に基づいている。
- ユーイング肉腫に見られるEWSR1-FLI1融合遺伝子と、慢性骨髄性白血病 (CML)に見られるBCR-ABL融合遺伝子を対象として、それぞれの癌細胞株、および、癌細胞株または患者由来組織を移植した免疫不全マウスにおいて、FO除去が進行し、腫瘍細胞増殖が抑制されることを実証した。
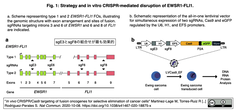 ユーイング肉腫EWSR1-FLI1融合遺伝子での検証
ユーイング肉腫EWSR1-FLI1融合遺伝子での検証[注] 標的イントロンについてFig. 1引用右図参照
- A673細胞とRD-ES細胞においてFO産物が減少し癌細胞の生存, 増殖, およびクローン形成能を阻害した。
- hMSC (初代ヒト間葉系幹細胞)には影響を及ぼさなかった。
- A673細胞を移植した免疫不全マウスに、FO標的Cas9-sgRNAをアデノウイルスベクターでデリバリすると、A673細胞の生存が阻害された。
- ユーイング肉腫患者由来の異種移植 (PDX)マウスモデルにおいて、癌細胞の減少と延命効果を確認した。
- 抗癌剤 (ドキソルビシン)との併用療法の相乗効果もin vitroとin vivoで確認した。
[注] 標的イントロンについてFig. 6引用右図参照
- CMLに見られるBCR-ABL1 (BA)融合遺伝子を標的とするCas9-sgRNAも、エレクトロポレーションを介してK562細胞の増殖を抑制した。
- また、PDXマウスにおいても癌細胞の増殖を抑制し、マウスに延命効果をもたらした。

コメント