[出典] "Development of a base editor for protein evolution via in situ mutation in vivo" Hao W, Cui W [..] Zhou Z. Nucleic Acids Res. 2021-08-14. https://doi.org/10.1093/nar/gkab673; Graphical abstract https://academic.oup.com/view-large/figure/286113892/gkab673gra1.jpg
タンパク質の人工進化はライフサイエンスの発展に大きく貢献してきたが,一部のタンパク質は,異種発現,精製,機能検出が困難であるため,in vitroでの進化は困難であった.研究グループは,nCas9とシトシンデアミナーゼ (CDA) をゲノムに導入することで,枯草菌において高効率な塩基エディター (BE), CRISPR-CDA-nCas9-UGI, を実現した.
- CRISPR-CDA-nCas9-UGIは,編集可能な領域でシチジンからチミジンへの変異を約100%誘発し,他のBEに比べてはるかに高い効率を示した.
- CRISPR-CDA-nCas9-UGIは,編集可能なウィンドウと変換効率の調整が簡単であり,変異体タンパク質ライブラリーを効率的に構築するのに適していた.
- 概念実証として,
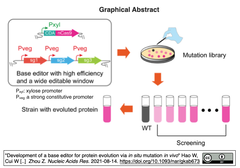 sgRNA多重化を介して枯草菌のタンパク質輸送に関わる膜タンパク質複合体である Secトランスロカーゼ複合体 (secY, secE, およびsecG)を生体内で進化させることに成功した.進化させたSec-トランスロカーゼ複合体をもとに、3.6倍のトランスロケーション効率を持つ宿主細胞を得た [Graphical Abstract引用右図参照].
sgRNA多重化を介して枯草菌のタンパク質輸送に関わる膜タンパク質複合体である Secトランスロカーゼ複合体 (secY, secE, およびsecG)を生体内で進化させることに成功した.進化させたSec-トランスロカーゼ複合体をもとに、3.6倍のトランスロケーション効率を持つ宿主細胞を得た [Graphical Abstract引用右図参照]. - さらに,枯草菌の膜タンパク質であるバシトラシン耐性関連タンパク質 (BceB)を生体内で進化させることにも成功し,バシトラシンに対する耐性が高い変異体と低い変異体をそれぞれ単離するに至った.
- こうした塩基エディターの構築には,その他の外来因子や宿主因子を必要としないことから,容易であり,膜タンパク質,毒性タンパク質,易動性タンパク質およびタンパク質複合体のin situ変異誘導を介したタンパク質進化のプラットフォームとして利用可能なバクテリアの範囲を広げる.
コメント