1.自己不活性Cas9システムKamiCas9を開発し、神経細胞とグリア細胞のハンチントン遺伝子を編集
- [出典] “The Self-Inactivating KamiCas9 System for the Editing of CNS Disease Genes.” Merienne N 〜 Déglon N. Cell Rep. 2017 Sep 19;20(12):2980-2991.
- 弱いプロモーター7SKとCas9の開始コドンATGを標的とするsgCas9をコンストラクトに組込むことで(挿入図下段中央のコンストラクト構成)、Cas9の一過性発現を実現するKamiCas9(挿入図上段グラグのグリーンの曲線)を開発。ハンチントン遺伝子(HTT)を標的とするsgHTTとCas9を標的とするsgCas9のレベルは一定に保たれ、sgHTTの標的HTTは低減する。
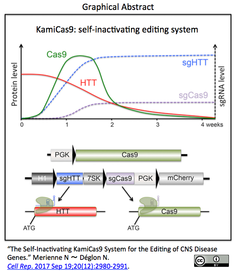
- KamiCas9は、マウスの初代培養神経細胞/グリア細胞、成体マウスの線条体、および患者由来iPSCから分化した神経細胞において、Cas9と同等のオンターゲット編集効率を示し、オフターゲット編集はsgHTTとsgCas9の双方について検出限界未満であった。
2.標的DNAとHR用テンプレートDNAに同時にニックを入れることで、二本鎖切断を介さずシームレスなゲノム編集を実現
- [出典] “In trans paired nicking triggers seamless genome editing without double-stranded DNA cutting.” Chen X 〜 Gonçalves MAFV. Nat Commun. 8, Article number: 657 (2017)
- CRISPR-Cas9によるDSBのドナーDNAを介した相同組換え修復(HR)による精密ゲノム編集が試みられているが、この手法には転座の発生やNHEJによる変異導入の問題を伴う。今回、ドナーDNAのプラスミドと標的ゲノムサイトの双方にニックを入れる(ssDNAを生成する)手法を開発し、iPSCを含むヒト細胞においてDSBを介することなく、大規模な遺伝子ターゲッティングをシームレスかつ多重に実現した。
- 具体的にはRuvC Cas9 変異体Asp10Ala (Cas9D10A) またはHNH Cas9 変異体 His840Ala (Cas9H840A)を作出・利用して、挿入図Figure1-aの右側にあるように内在DNA(標的ゲノム領域)と外来DNA(HDR用DNA)の双方から同時にssDNAを生成することで精密なゲノム編集を実現した。

コメント