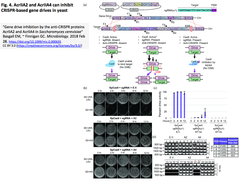
1.SpCas9活性と遺伝子ドライブを抗-CRISPRタンパク質 (AcrIIA2; AcrIIA4)によって調節する:酵母での実証
- [出典] "Gene drive inhibition by the anti-CRISPR proteins AcrIIA2 and AcrIIA4 in Saccharomyces cerevisiae" Basgall EM, ~ Finnigan GC. Microbiology. 2018 Feb 28.
- 抗-CRISPRタンパク質は、酵母の一倍体細胞in vivoでSpCas9を阻害し (下図左 Fig. 2)、遺伝子ドライブを阻害 (下図右 Fig. 4)する。
- アラニンスキャニング実験により抗-CRISPRタンパク質の活性と導入変異の関係を明らかにし、AcrIIA4の変異体とその発現量によって、SpCas9の活性ひいては遺伝子ドライブを調節可能なことを実証。
2.Cas9を阻害する抗-CRISPRタンパク質AcrIIA4の溶液構造とダイナミクス
- [出典] "Solution structure and dynamics of anti-CRISPR AcrIIA4, the Cas9 inhibitor" Kim I, Jeong M, Ka D, Han M, Kim NK, Bae E, Suh JY. Sci Rep. 2018 Mar 1;8(1):3883.; PDB-5XN4/BMRB-36085
- Listeria monocytogenes由来AcrIIA4の構造をNMR解析;SpyCas9のRuvCドメインなどと相互作用するループのマイクロ秒からミリ秒スケールのダイナミクスが明らかに;AcrIIA4 はアポSpyCas9に解離定数~4.8μMで、sgRNA結合SpyCas9には解離定数~0.6nMで結合
3.LTRにTRACを標的とするsgRNAを組み込むCRISPR/Cas9システムを利用した'universal'CAR-T細胞
- [出典] "Long Terminal Repeat CRISPR-CAR coupled 'universal'T cells mediate potent anti-leukemic effects" Georgiadis C et al. Mol Ther. 2018 Feb 28.
- 2017年にMichel SadelainらSloan Lettering Institueの研究チームが、CRISPR/Cas9技術によるCD19特異的CAR (キメラ抗原受容体(CAR) のTRAC(T-cell receptor α constant)遺伝子座への導入により、CAR-T療法の安全性と腫瘍抑制性を向上可能なことを示した (Targeting a CAR to the TRAC locus with CRISPR/Cas9 enhances tumour rejection)。
- 英国と韓国の研究チームは今回、 TRACを標的とするsgRNAをレンチウイルスのΔU3 3’ LTRに挿入しておき、Cas9 mRNAを送達することで、極めて均一なCAR-TCR T細胞のエンリッチメントを実現;このTerminal-TRAC (TT)- CAR T細胞は、ヒト化免疫不全マウスにおいて安定に長期間抗白血病効果を示した。
4.[プロトコル]患者由来iPSCsのCRISPR-Cas9ゲノム編集
- [出典] "CRISPR-Cas9-Based Genome Editing of Human Induced Pluripotent Stem Cells" Giacalone JC, Sharma TP, Burnight ER, Fingert JF, Mullins RF, Stone EM, Tucker BA. Curr Protoc Stem Cell Biol. 2018 Feb 28.
- 効率的なゲノム編集の設計戦略と手法;正の選択により目的とする遺伝子改変を帯びているクローンのエンリッチメント;Cre-lox組み換えによる選択マーカの除去;負の選択による選択マーカ残存iPSCsの排除。
5.CRISPR-Cas9によるヒト遺伝子編集が抱える課題:医学的問題と社会的問題
- [出典] "Counterpoint: The Potential Harms of Human Gene Editing Using CRISPR-Cas9" Baylis F. Clin Chem. 2018 Mar;64(3):489-491.
6.CRISPR/Cas9による高効率かつ低コストなmiRNA検出法
- [出典] "High-Effective and Low-Cost microRNA Detection with CRISPR-Cas9" Qiu XY, ~ Zhu L.ACS Synth Biol. 2018 Mar 7.
- 等温遺伝子増幅法 (isothermal amplification)、dCas9-gRNAおよびsplit HRP (split-horseradish peroxidase)法を組み合わせたmiRNA検出法を開発
7.ショウジョウバエ必須遺伝子のプール型ゲノムワイドCRISPRスクリーニング
- [出典] "Pooled genome-wide CRISPR screening for basal and context-specific fitness gene essentiality in Drosophila cells" Viswanatha R, Li Z, Hu Y, Perrimon N. bioRxiv. Posted March 1, 2018. > eLife 2018-07-27.
- 昆虫細胞では効率が低いレンチウイルスによる送達に替えて、phiC31インテグラーゼを利用して、Drosophila S2R+から誘導したPT5細胞におけるattPサイトと、gRNAプラスミド上のattBサイトとの間の部位特異的組み換えにより、gRNA送達;ベーシックな条件下で必須遺伝子1,235種類を同定、加えて、コンテクストに依存 (Ras/ERK/ETS阻害トラメチニブまたはmTOR阻害分子ラパマイシン暴露)した必須遺伝子を同定
8.CRISPR/Cas9遺伝子編集により、モデルマウスを利用した宿主ー病原菌間相互作用研究にマウスの遺伝的背景が与える影響を解明する試み
- [出典] "The use of CRISPR/Cas9 gene editing to confirm congenic contaminations in host-pathogen interaction studies" Ferrand J, ~ Gantier MP. Front Cell Infect Microbiol. Accepted 2018 Mar 02.
- ネズミチフス菌 (Salmonella enterica serovar Typhimurium) 感染マウスモデルを対象として、CRISPR/Cas9によりマクロファージをノックアウトした細胞株を利用
9.ゼブラフィッシュをモデルとして、効率的に体細胞点変異を誘導し生殖細胞伝達を選別するCRISPR/Cas9遺伝子編集プラットフォームを開発
- [出典] "An Efficient Platform for Generating Somatic Point Mutations with Germline Transmission in the Zebrafish by CRISPR/Cas9-mediated Gene Editing" Zhang Y, Zhang Z, Ge W. J Biol Chem. 2018 Mar 2.
- HDRを介したゼブラフィッシュのY box binding protein 1 (Ybx1/ybx1) へのS82A変異導入効率74%を達成;加えて、indel変異が混在する中でからS82A変異を継承した細胞選別法も確立;HDRに関する主要な条件(DNAドナーのタイプ、NHEJの抑制、HDRパスウイの活性化、およびCas9送達(mRNAに替えてタンパク質送達))を最適化
10.CRISPR/Cas9技術による外来遺伝子を含まない植物変異体の作出とスクリーニング
- [出典] "A method for the production and expedient screening of CRISPR/Cas9-mediated non-transgenic mutant plants" Chen L, ~ Li Y. Hortic Res. 2018 Mar 2.
- Agrobacteriumを介してCRISPR/Cas9を一時的に発現させすることで、非遺伝子組み換え植物変異体を作出;Illumunaシーケンシングとhigh-resolution melting (HRM) 法による迅速、低経費、ハイスループットなスクリーニング法も確立;四倍体タバコとフィトエン不飽和化酵素遺伝子をモデルとして実証 (抗生物質選択を介さず編集効率47.5%を達成し、そのうち17.2%に外来遺伝子無し)
11.多倍数体性アルファルファにおいてsquamosa promoter binding protein like 9 (SPL9) 遺伝子編集を実現
- [出典] "Gene editing by CRISPR/Cas9 in the obligatory outcrossing Medicago sativa" Gao R, Feyissa BA, Croft M, Hannoufa A. Planta. 2018 Feb 28
12.[レビュー]CRISPR-Casの生物学
- [出典] "The Biology of CRISPR-Cas: Backward and Forward" Hille F, ~ Charpentier E. Cell. 2018 Mar 8;172(6):1239–1259.
- Emmanuelle Charpentierらによるレビュー
13.[In Brief]CRISPR-Casはファージを介した形質導入を介してHGTを亢進する
- [出典] "Viral infection: CRISPR–Cas enhances HGT by transduction" Du Toit A. Nat Rev Microbiol. 2018 Feb 26.
- mBioに発表されたBridget N. J. Watsonらの論文(*)をハイライト。遺伝子の水平伝播 (HGT)の主要な機構には、自然形質転換 (natural transformation)、接合 (conjugation)および形質導入 (transduction: ファージによるバクテリアからバクテリアへのDNA伝搬)がある。CRISPR-Cas9は、ファージ感染抵抗性に加えて、conjugationとtransformationを阻害することが示されてきたが、transductionとの関連は不明であった。Watsonらは今回、Pectobacterium atrosepticumにおいて、CRISPR-Casが形質導入を介してHGTを亢進するとした。
- (*)"CRISPR-Cas-Mediated Phage Resistance Enhances Horizontal Gene Transfer by Transduction" Watson BNJ, Staals RHJ, Fineran PC. mBio. 2018 Feb 13;9(1):e02406-17.

コメント